GSEA富集分析可视化
上一次推文已经给大家介绍了常见的富集分析类型以及如何使用全能的R包相必大家也知道的富集结果可以画出很多漂亮的图,其中enrichplot是专门用于对接的富集结果的可视化R包。但是大家有没有这样的困惑呢?ehrichplot今天就先给大家详细介绍enrichplot包。当然了,富集分析的可视化还有许多其他R包,我们会在后续的推文中继续介绍。
今天给大家介绍GSEA,基因集富集分析,的可视化!主要是带你详细了解如何自定义GSEA的经典图形。
之前的推文已经带大家了解了富集分析的常见类型以及如何使用clusterprofiler进行富集分析,如何使用enrichplot进行可视化:
不过在上期内容中,我们主要是以ORA为例,演示了如何进行可视化,虽然enrichplot的画图函数对于ORA和GSEA都是支持的(参考上期内容),但是我们并没有过多介绍GSEA富集分析的可视化内容,主要是因为部分函数是专门针对GSEA的。
所以本期内容会详细介绍GSEA可视化及如何自定义。
本期目录:
准备数据
用gse87466这个GEO的数据做演示,下载整理的过程这次就不演示了。数据可以免费在粉丝QQ群获取。
library(easyTCGA)
load(file = "G:/easyTCGA_test/gse87466.Rdata")
这是一个炎症性肠病的数据集,一共108个样本,21个normal,87个uc(ulcerative colitis)。
探针注释我已经提前做好了,但是有一些探针对应多个symbol,为了方便我这里直接删掉了:
exprSet[1:4,1:4]
## GSM2332098 GSM2332099 GSM2332100
## IGK@ /// IGKC 13.86197 13.76880 13.95740
## 13.95740 13.92619 13.79664
## IGL@ 13.73797 13.61266 13.86197
## IGH@ /// IGHA1 /// IGHA2 /// LOC100126583 13.79664 13.16844 13.76880
## GSM2332101
## IGK@ /// IGKC 13.95740
## 13.86197
## IGL@ 13.76880
## IGH@ /// IGHA1 /// IGHA2 /// LOC100126583 13.73797
group <- factor(group_list,levels = c("normal","UC"))
table(group)
## group
## normal UC
## 21 87
首先对这个数据做下差异分析,也是用easyTCGA包,1行代码即可,基因芯片数据也是支持的,并且它会自动检测需不需要进行log2转换,如果是count矩阵,会自动使用DESeq2、limma、edgeR进行差异分析,如果不是,会自动进行wilcoxon和limma的差异分析:
library(easyTCGA)
diff_res <- diff_analysis(exprset = exprSet
, group = group
, is_count = F
)
## log2 transform not needed
## => Running limma
## => Running wilcoxon test
## => Analysis done.
# limma的结果
diff_limma <- diff_res$deg_limma
# 多个gene symbol的直接删除,方便演示
diff_limma <- diff_limma[!grepl("/",diff_limma$genesymbol),]
head(diff_limma)
## logFC AveExpr t P.Value adj.P.Val B
## SLC6A14 5.024103 9.413107 21.56440 4.104849e-41 8.514279e-37 82.58182
## LOC389023 -3.550396 5.541681 -21.01057 4.054400e-40 4.204818e-36 80.36199
## SLC23A1 -2.473180 5.649224 -17.88487 3.378001e-34 2.335550e-30 67.08748
## DUOX2 4.911030 9.916299 17.37129 3.569259e-33 1.850839e-29 64.78265
## DPP10 -1.910958 3.991413 -16.98863 2.113068e-32 7.304876e-29 63.04259
## TIMP1 2.125930 11.402645 16.88534 3.425860e-32 1.015131e-28 62.56956
## genesymbol
## SLC6A14 SLC6A14
## LOC389023 LOC389023
## SLC23A1 SLC23A1
## DUOX2 DUOX2
## DPP10 DPP10
## TIMP1 TIMP1
GSEA富集分析
富集分析首选clusterProfiler,没有之一!简单,好用!
clusterProfiler为我们提供了非常好用的ID转换函数,这里的ID转换和上面说的探针注释并不是一回事:
library(clusterProfiler)
##
## clusterProfiler v4.6.2 For help: https://yulab-smu.top/biomedical-knowledge-mining-book/
##
## If you use clusterProfiler in published research, please cite:
## T Wu, E Hu, S Xu, M Chen, P Guo, Z Dai, T Feng, L Zhou, W Tang, L Zhan, X Fu, S Liu, X Bo, and G Yu. clusterProfiler 4.0: A universal enrichment tool for interpreting omics data. The Innovation. 2021, 2(3):100141
##
## Attaching package: 'clusterProfiler'
## The following object is masked from 'package:stats':
##
## filter
gene_entrezid <- bitr(geneID = diff_limma$genesymbol
, fromType = "SYMBOL" # 从symbol
, toType = "ENTREZID" # 转成ENTREZID
, OrgDb = "org.Hs.eg.db"
)
##
## 'select()' returned 1:many mapping between keys and columns
head(gene_entrezid)
## SYMBOL ENTREZID
## 1 SLC6A14 11254
## 3 SLC23A1 9963
## 4 DUOX2 50506
## 5 DPP10 57628
## 6 TIMP1 7076
## 7 LCN2 3934
富集分析最好用ENTREZID进行,关于多种不同的ID,在曾老师的书中都有详细介绍,强烈推荐初学者一定要看:生信初学者基础知识资源推荐
做GSEA分析对数据格式有要求,之前也说过,需要是一个有序的数值型向量,其名字是基因的ID
gene_entrezid <- merge(gene_entrezid,diff_limma,by.x = "SYMBOL", by.y = "genesymbol")
genelist <- gene_entrezid$logFC
names(genelist) <- gene_entrezid$ENTREZID
genelist <- sort(genelist,decreasing = T)
head(genelist)
## 4314 11254 50506 1673 1116 6279
## 5.123666 5.024103 4.911030 4.608619 4.552790 4.256463
我们使用msigdbr包从msigdb数据库下载人类的C5注释集,大家常用的GO、KEGG的数据其实都是包括在msigdb数据库中的。
library(msigdbr)
m_t2g <- msigdbr(species = "Homo sapiens", category = "C5") %>%
dplyr::select(gs_name, entrez_gene)
head(m_t2g)
## # A tibble: 6 × 2
## gs_name entrez_gene
## <chr> <int>
## 1 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 60496
## 2 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 10840
## 3 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 160428
## 4 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 4522
## 5 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 25902
## 6 GOBP_10_FORMYLTETRAHYDROFOLATE_METABOLIC_PROCESS 441024
然后是进行GSEA分析:
gsea_res <- GSEA(genelist,
TERM2GENE = m_t2g,
minGSSize = 10,
maxGSSize = 500,
pvalueCutoff = 0.05,
pAdjustMethod = "BH",
seed = 456
)
## preparing geneSet collections...
## GSEA analysis...
## leading edge analysis...
## done...
富集分析得到的结果是一个对象,关于这个对象包括那些东西,如何对它进行各种操作,我们在之前的推文都介绍过了,这里就不多说了~
如何查看某个条目下的所有基因名字,很简单,也是不断的取子集操作:
# 第一个条目的所有基因
gsea_res[[gsea_res$ID[[1]]]]
## [1] "1673" "5068" "2919" "5967" "5968" "1670" "1671" "2920"
## [9] "3553" "6373" "4283" "10563" "6374" "6372" "6283" "2921"
## [17] "6280" "1755" "3627" "5266" "718" "725" "4057" "931"
## [25] "629" "3426" "6278" "28461" "1604" "6347" "54210" "3495"
## [33] "1380" "1378" "1191" "722" "1880" "5199" "5648" "5788"
## [41] "1235" "9308" "717" "3569" "3500" "710" "11005" "5196"
## [49] "716" "715" "1236" "64127" "5079" "940" "3507" "28639"
## [57] "10417" "2219" "5452" "124976" "2213" "5450" "10578" "28912"
## [65] "3514" "6590" "3119" "6036" "3853" "7124" "4068" "5919"
## [73] "4049" "6406" "8547" "3605" "5473" "3458" "729230" "6480"
## [81] "240" "3123" "4239"
下面进入今天的正题,可视化!
library(enrichplot)
library(ggplot2)
enrichplot中包含超多种可视化方法,可以前一篇推文,我们今天主要介绍专门针对GSEA结果的可视化。
峰峦图
通过函数ridgeplot函数实现。展示核心富集基因的表达倍数变化的分布情况。
X轴是核心基因的表达倍数变化,正值表示上调,负值表示下调。
ridgeplot(gsea_res,
showCategory = 20,
fill = "p.adjust", #填充色 "pvalue", "p.adjust", "qvalue"
core_enrichment = TRUE,#是否只使用 core_enriched gene
label_format = 30,
orderBy = "NES",
decreasing = FALSE
)+
theme(axis.text.y = element_text(size=8))
## Picking joint bandwidth of 0.212

gseadist
展示基因集的logFC分布
ids <- gsea_res@result$ID[10:15]
gseadist(gsea_res,
IDs = ids,
type="density" # boxplot
)+
theme(legend.direction = "vertical")

gsearank
展示基因的排序以及富集分数的变化。
gsearank(gsea_res,
geneSetID = 1 # 要展示的基因集
)

这个函数还可以直接返回画图数据:
aa <- gsearank(gsea_res, 1, title = gsea_res[1, "Description"],output = "table")
head(aa)
## gene rank in geneList running ES core enrichment
## 1 1673 4 0.02593614 YES
## 2 5068 8 0.04789110 YES
## 3 2919 9 0.06921595 YES
## 4 5967 10 0.09013150 YES
## 5 5968 11 0.11055815 YES
## 6 1670 19 0.12821970 YES
gseaplot
接下来着重介绍gseaplot和gseaplot2函数。
gseaplot函数可以画两个图:ES或者ranked-gene-list,通过参数by设置,默认是两个图都画出来,如果by="runningScore",则是画出ES的图,如果是by = "preranked",则是画出ranked gene list的图,
p <- gseaplot(gsea_res, geneSetID = 1, by = "runningScore",
title = gsea_res$Description[1])
p

单独画的时候这两个图都是ggplot2对象,可以使用所有ggplot2语法修改图形。
p+theme(plot.title = element_text(size = 8,color="red"))

单独画logfc标准化(也可以选择其他度量方式)之后进行排序的图形:
p <- gseaplot(gsea_res, geneSetID = 1, by = "preranked",
title = gsea_res$Description[1])
p

可以直接使用ggplot2语法进行修改:
p+theme(plot.title = element_text(size = 10,color="blue"))

如果两个子图都画的话返回的是一个ggplist对象,此时如果要修改图形细节,可以使用取子集的方法提取其中的子图形,此时的子图形是ggplot对象,又可以使用ggplot2语法修改了。
#直接加theme返回null,因为是gglist,不是ggplot object
p <- gseaplot(gsea_res,geneSetID = 1,title = gsea_res$Description[1])
p

此时的标题可能太大了,需要改小一点,可以通过以下方法进行:
#取子集进行修改
p[[1]] <- p[[1]]+theme(plot.title = element_text(size = 6))
p

所有的细节都支持使用这种方式进行修改!因为它本质上还是ggplot对象,只不过是拼图而已。
gseaplot2
基本图形
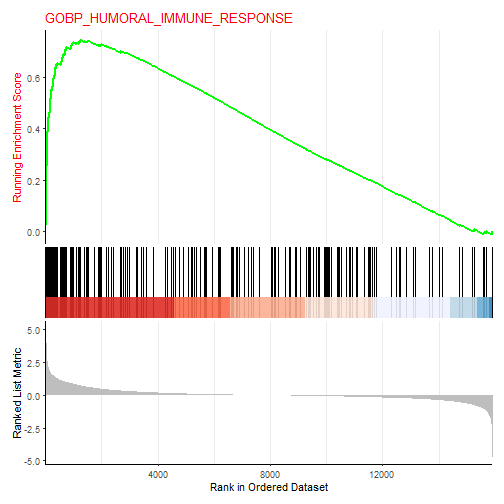
GSEA富集分析的主要可视化图形还是以下这种,通过gseaplot2实现:
# 默认subplots = 1:3,把3个图放一起
gseaplot2(gsea_res,geneSetID = 1,title = "title",
subplots = 1:3,
base_size = 10)

这张图是由3部分组合而成的,3个部分由参数subplots控制,所以也不是ggplot-object,而是gglist,所以如果你要修改其中细节,也是要通过取子集的方法进行。
下面是第一个子图:
gseaplot2(gsea_res, geneSetID = 1, subplots = 1)

下面是第1和第2个子图拼一起:
gseaplot2(gsea_res, geneSetID = 1, subplots = 1:2)

第3个子图是什么样的应该就不用演示了~
支持通过提取子图进行自定义修改:
#把entrezid变为symbol
gsea_res_symbol <- setReadable(gsea_res,"org.Hs.eg.db","ENTREZID")
p <- gseaplot2(gsea_res_symbol,geneSetID = 1,
title = gsea_res_symbol$Description[1])
p[[1]] <- p[[1]]+
theme(title = element_text(color = "red"))
p

展示多条通路
可以同时画多条通路。
tmp <- as.data.frame(gsea_res_symbol)
colnames(tmp)
## [1] "ID" "Description" "setSize" "enrichmentScore"
## [5] "NES" "pvalue" "p.adjust" "qvalue"
## [9] "rank" "leading_edge" "core_enrichment"
head(tmp,2)
## ID
## GOBP_HUMORAL_IMMUNE_RESPONSE GOBP_HUMORAL_IMMUNE_RESPONSE
## GOBP_ADAPTIVE_IMMUNE_RESPONSE GOBP_ADAPTIVE_IMMUNE_RESPONSE
## Description setSize
## GOBP_HUMORAL_IMMUNE_RESPONSE GOBP_HUMORAL_IMMUNE_RESPONSE 226
## GOBP_ADAPTIVE_IMMUNE_RESPONSE GOBP_ADAPTIVE_IMMUNE_RESPONSE 431
## enrichmentScore NES pvalue p.adjust
## GOBP_HUMORAL_IMMUNE_RESPONSE 0.7441821 2.629284 1e-10 7.277857e-09
## GOBP_ADAPTIVE_IMMUNE_RESPONSE 0.6841391 2.548253 1e-10 7.277857e-09
## qvalue rank leading_edge
## GOBP_HUMORAL_IMMUNE_RESPONSE 5.821805e-09 1251 tags=37%, list=8%, signal=34%
## GOBP_ADAPTIVE_IMMUNE_RESPONSE 5.821805e-09 2125 tags=46%, list=13%, signal=41%
比如我们通过查找发现自己想要把第4,5,6个通路画在一起,只要给geneSetID提供参数即可:
#提供多个通路
p <- gseaplot2(gsea_res,geneSetID = 4:6)
p

现在这个通路名字很长,显示不全,如果你对ggplot很熟悉你就能知道上面这张图的通路名字在这里很明显就是一个图例,所以我们可以取子图,然后对子图进行操作,把图例放到图形上方:
p[[1]] <- p[[1]]+theme(legend.position = "top",legend.direction = "vertical")
p

当然你也可以通过修改图例标签实现,详情请见:ggplot2修改图例详细解读
p <- gseaplot2(gsea_res,geneSetID = 4:6)
p[[1]] <- p[[1]]+scale_color_hue(labels=c("aa","bb","cc"))
p

当然一些比较简单的参数y叔已经给你准备好了,比如base_size控制整体字体大小,color改变颜色映射。
p <- gseaplot2(gsea_res,geneSetID = 4:6,
base_size = 10,
color = c("#E495A5", "#86B875", "#7DB0DD")
)
p

但是如果你需要个性化的出图或者为了发文章,那肯定是需要自己DIY一番的喽~
p <- gseaplot2(gsea_res,geneSetID = 4:6)
p[[1]] <- p[[1]]+scale_color_viridis_d(labels=c("lalala","heiheihei","dadada"))+
geom_hline(yintercept = 0,color="grey75", linewidth=0.8,linetype=2)+
theme(legend.position = "top")
p[[2]] <- p[[2]]+scale_color_viridis_d()
p[[3]] <- p[[3]]+geom_hline(yintercept = 0,color="steelblue", linewidth=0.5,linetype=2)
p

所有的一切都可以自定义!这么多ggplot2的语法我是怎么知道的呢?很简单,两本ggplot2说明书:《R数据可视化手册》和《ggplot2数据分析与图形艺术》,买一本认真看一遍你就懂了!
展示P值信息
除此之外还可以显示pvalue信息,但是很遗憾不能显示NES~
#有些通路名字很长,表格会显示不出来,注意调整图形宽度
p <- gseaplot2(gsea_res, geneSetID = 4:6,
pvalue_table = TRUE # 显示pvalue
)
p

你会发现通路名字不是很长,表格有时会显示不出来,但是此时通路名字变成了annotate而不是图例,所以就不能像上面修改图例那样修改这里的通路名字了!
# 这段代码没啥用了~
p[[1]] <- p[[1]]+
theme(legend.position = "top",
legend.direction = "vertical"
)
p

这里的通路名字并不是图例,所以上面的代码并没有达到把通路名字移走的效果~
这种情况下通路名字和p_value table其实是annotate。
gseaplot2函数中对这个annotate的处理如下代码所示:
if (pvalue_table) {
pd <- x[geneSetID, c("Description","pvalue", "p.adjust")]
# pd <- pd[order(pd[,1], decreasing=FALSE),]
rownames(pd) <- pd$Description
pd <- pd[,-1]
# pd <- round(pd, 4)
for (i in seq_len(ncol(pd))) {
pd[, i] <- format(pd[, i], digits = 4)
}
tp <- tableGrob2(pd, p.res)
p.res <- p.res + theme(legend.position = "none") +
annotation_custom(tp,
xmin = quantile(p.res$data$x, .5),
xmax = quantile(p.res$data$x, .95),
ymin = quantile(p.res$data$runningScore, .75),
ymax = quantile(p.res$data$runningScore, .9))
}
那这样的话其实我们可以自己添加,绝对更加个性化,想怎么弄都行。
如果你一定要用ggplot2的默认颜色,可以通过以下方式获取,scales作为ggplto2扩展包,功能十分实用,我们之前也详细介绍过:实用R包scales包介绍
library(scales)
hex <- hue_pal()(3)
hex
## [1] "#F8766D" "#00BA38" "#619CFF"
这个annotate其实是一个gtable对象,我们可以通过gridExtra包实现对它的精细化控制,然后把它加到图形中即可。
library(gridExtra)
# 选择4,5,6条通路
x <- gsea_res_symbol
geneSetID <- 4:6
# 提取NES,P值等信息
pd <- x[geneSetID, c( "NES","pvalue", "p.adjust")]
pd <- pd[order(rownames(pd), decreasing=FALSE),]
for (i in seq_len(ncol(pd))) {pd[, i] <- format(pd[, i], digits = 4)}
# 通过修改table的主题来修改表格细节
tt <- ttheme_minimal(base_size = 10,
core=list(#bg_params = list(fill = NA, col=NA),
fg_params=list(col=c("#F8766D","#00BA38","#619CFF"))
)
)
tp <- tableGrob(pd,rows = NULL,theme = tt)
# 修改表格每个格子的宽度和高度
#tp$widths <- unit(rep(1.2,ncol(tp)), "cm")
tp$heights <- unit(rep(0.4,nrow(tp)),"cm") # cell height
这样一个表格就画好了,可以画出来看一下先:
plot(tp)

就是我需要的效果!
有了这个东西,我们取子集,然后用ggplot2语法DIY即可:
p <- gseaplot2(gsea_res, geneSetID = 4:6)
p[[1]] <- p[[1]]+
annotation_custom(tp,
xmin = 10000,
xmax = 14000,
ymin = 0.4,
ymax = 0.8
)+
theme(plot.title = element_text(size = 5),
legend.position = "top",
legend.direction = "vertical"
)
p

很好,就是我需要的最终效果,其他颜色、大小这些就不再演示了~
除此之外,ggpp包也能达到类似的效果,下面是一个简单的演示:
x <- gsea_res_symbol
geneSetID <- 4:6
pd <- x[geneSetID, c( "NES","pvalue", "p.adjust")]
rownames(pd) <- NULL
for (i in seq_len(ncol(pd))){pd[, i] <- format(pd[, i], digits = 4)}
通过ggpp中的annotate函数实现:
library(ggpp)
##
## Attaching package: 'ggpp'
## The following object is masked from 'package:ggplot2':
##
## annotate
p <- gseaplot2(gsea_res, geneSetID = 4:6)
p[[1]] <- p[[1]]+
annotate("table", x = 12000, y = 0.4, label = pd,
size=3,table.theme = ttheme_gtminimal
)+
theme(plot.title = element_text(size = 5),
legend.position = "top",
legend.direction = "vertical"
)
p

但是这样的问题是并不能知道哪条通路的值,因为全是黑色,这个包还有一个geom_table函数,理论上可以为不同的行映射不同的颜色,大家可以自己探索下~
展示基因名字
在通路中添加想要展示的基因呢?通过geom_gsea_gene函数即可。
#选择基因
symbol <- gsea_res_symbol[[gsea_res_symbol$ID[[1]]]]
head(symbol)
## [1] "DEFB4A" "REG3A" "CXCL1" "REG1A" "REG1B" "DEFA5"
length(symbol)
## [1] 83
# 随便选5个
g <- sample(symbol,5)
g
## [1] "C1R" "C4BPB" "IL6" "LTA" "CCL2"
添加到图形中即可:
p <- gseaplot(gsea_res_symbol, 1, by='runningScore')
p+geom_gsea_gene(g)

还是可以通过取子集的方式修改其中的子图形:
p <- gseaplot(gsea_res_symbol, 1)
p

p[[2]] <- p[[2]]+geom_gsea_gene(g, geom = ggplot2::geom_label)
p

geom_gsea_gene函数当然也是支持gseaplot2的:
library(ggrepel)
p <- gseaplot2(gsea_res_symbol, geneSetID = 6)
p[[1]] <- p[[1]]+geom_gsea_gene(g, geom=geom_text_repel)+
theme(legend.position = "top",
legend.direction = "vertical"
)
p

多条通路当然也没有问题:
# 每条通路随便展示3个基因
g <- sample(symbol,3)
p <- gseaplot2(gsea_res_symbol, geneSetID = 4:6)
p[[1]] <- p[[1]]+geom_gsea_gene(mapping = aes(color= Description),
g,
geom=geom_text_repel)+
theme(legend.position = "top",
legend.direction = "vertical"
)
p

可以看到有些基因是重复的,因为所有通路都是展示的这几个基因,可以通过分别提取子集再添加基因的方式展示不同通路中的不同基因:
g11 <- sample(gsea_res_symbol[[gsea_res_symbol$ID[1]]],5)
g22 <- sample(gsea_res_symbol[[gsea_res_symbol$ID[2]]],5)
g33 <- sample(gsea_res_symbol[[gsea_res_symbol$ID[3]]],5)
desc <- gsea_res_symbol$Description[1:3]
p <- gseaplot2(gsea_res_symbol, geneSetID = 1:3)
p[[1]] <- p[[1]] +
geom_gsea_gene(mapping=aes(colour = Description), g11, geom=geom_text_repel, geneSet=desc[1]) +
geom_gsea_gene(mapping=aes(colour = Description), g22, geom=geom_text_repel, geneSet=desc[2]) +
geom_gsea_gene(mapping=aes(colour = Description), g33, geom=geom_text_repel, geneSet=desc[3])
p

今天的内容就到这里,后面会继续给大家介绍富集分析可视化。

开放原子开发者工作坊旨在鼓励更多人参与开源活动,与志同道合的开发者们相互交流开发经验、分享开发心得、获取前沿技术趋势。工作坊有多种形式的开发者活动,如meetup、训练营等,主打技术交流,干货满满,真诚地邀请各位开发者共同参与!
更多推荐
 已为社区贡献38条内容
已为社区贡献38条内容





所有评论(0)